En química, la concentración molar (también llamada molaridad) es una medida de la concentración de un soluto en una disolución, o de alguna especiemolecular, iónica, o atómica que se encuentra en un volumen dado. Sin embargo, en termodinámica la utilización de la concentración molar a menudo no es conveniente, porque el volumen de la mayor parte de las soluciones depende en parte de la temperatura, debido a la dilatación térmica. Este problema se resuelve normalmente introduciendo coeficientes o factores de corrección de la temperatura, o utilizando medidas de concentración independiente de la temperatura tales como la molalidad.
La concentración molar o molaridad c (o M) se define como la cantidad de soluto por unidad de volumen de disolución, o por unidad de volumen disponible de las especies:
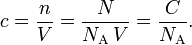
Aquí, n es la cantidad de soluto en moles, N es el número de moléculas presentes en el volumen V (en litros), la relación N/V es la densidad numérica C, y NA es el número de Avogadro, aproximadamente 6,022 . 1023 mol−1.O más sencillamente: 1 molar = 1 M = 1 mol/litro.

|